Kennzeichnungsvorschriften für Medizinprodukte
Kennzeichnungsvorschriften
Das System zur eindeutigen Identifizierung von Medizinprodukten (Unique Device Identification, kurz UDI) soll die Rückverfolgbarkeit von Medizinprodukten erleichtern, die Wirksamkeit sicherheitsrelevanter Maßnahmen nach dem Inverkehrbringen erhöhen und eine bessere Überwachung durch die Behörden ermöglichen, indem es die eindeutige Identifizierung eines bestimmten Medizinprodukts auf dem Markt erlaubt.
Zu diesem Zweck schreibt die UDI-Verordnung vor, dass das Medizinprodukt selbst (bei wiederverwendbaren Produkten) und alle höheren Verpackungsebenen mit einem eindeutigen UDI Code in maschinenlesbarem (Barcode) und menschenlesbarem Format gekennzeichnet sein müssen.
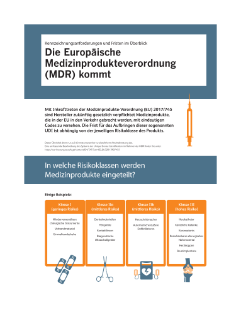
Die Palette der Medizinprodukte reicht von Einwegprodukten mit geringem Risiko, wie Produkten der Klasse I (elastische Bandagen, Handschuhe etc.) über Produkte der Klasse II mit mittlerem Risiko (chirurgisches Nahtmaterial, Infusionspumpen, Hörgeräte etc.) bis zu Produkten der Klasse III mit hohem Risiko (Herzschrittmacher, künstliche Gelenke und andere Implantate).
All diese Medizinprodukte benötigen eine UDI Kennzeichnung. Für die Anbringung der UDI auf dem Etikett, der Verpackung oder dem Produkt selbst stehen je nach Material verschiedene Technologien zur Verfügung.
Kennzeichnungslösungen für die UDI Kennzeichnung von Medizinprodukten
- DuPont™ Tyvek®: Videojet Thermal Inkjet Drucker (TIJ), Thermotransferdrucker (TTO) und UV-Laserkennzeichnungssysteme sind ideale Lösungen für die Anbringung von UDI-Codes auf Verpackungen aus Tyvek®. Die UV-Laserkennzeichnung liefert kontrastreiche, permanente Codes, die resistent gegen Abriebmittel, Chemikalien und Sterilisationsprozesse sind und eine lebenslange Rückverfolgbarkeit von Medizinprodukten ermöglichen.
- Beutel: Beutelverpackungen können aus verschiedenen Materialien bestehen, wie Tyvek®, medizinischem Papier, Metallfolie oder Film. Videojet TTO, TIJ und Continuous Inkjet Drucker (CIJ) eignen sich am besten für die UDI Kennzeichnung auf verschiedenen Beutelmaterialien.
- Rostfreier Stahl: Viele Medizinprodukte enthalten Komponenten aus Edelstahl. Zur direkten Kennzeichnung von Medizinprodukten, die hochdichte Materialien wie Metall, Aluminium, Edelstahl und Kunststoffe enthalten, werden häufig Faserlaserkennzeichnungssysteme eingesetzt, da sie permanente, gestochen scharfe Codes erzeugen können, die auch intensiver Abnutzung und wiederholter Sterilisation standhalten.
- Anwendungshinweise
- Infografik